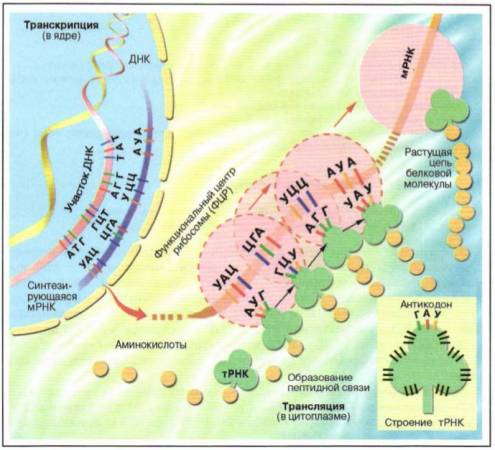
В чем заключаются особенности строения белков как биополимеров?
Белки – биополимеры. Название «белок» впервые было дано веществу птичьих яиц, которое свертывается при нагревании в белую нерастворимую массу. Позднее этот термин распространился и на другие вещества с подобными свойствами, выделенные из живых организмов. С середины XX в. белки стали называть также «протеинами» (от греч. protos – первый), подчеркнув важность этих веществ для жизни.
Белки – это сложные органические вещества. Молекулы белка состоят из атомов углерода, водорода, кислорода и азота. В некоторых белковых молекулах находятся атомы серы. Иногда белки образуют комплексы с другими молекулами, содержащими фосфор, железо, цинк, медь и т. д.
Масса белковых молекул очень велика, поэтому их называют макромолекулами. Такие макромолекулы состоят из повторяющихся, сходных по структуре низкомолекулярных соединений – мономеров (от греч. monos – один, единый). Образованная мономерами макромолекула называется полимером (от греч. poly – много). Белки являются биополимерами, их мономерами служат аминокислоты.
В природе существуют около 120 аминокислот, но лишь 20 из них входят в состав белков. Животные клетки (в том числе клетки человека) способны синтезировать некоторые (но не все) аминокислоты при наличии нужных исходных веществ. Некоторые аминокислоты не могут синтезироваться в организме животных (такие аминокислоты называются незаменимыми). Например, для организма взрослого человека незаменимыми являются восемь аминокислот, а для детского организма – десять. Незаменимые аминокислоты в организм человека поступают с растительной пищей. Растения же способны синтезировать все аминокислоты.
Взаимодействие двух молекул аминокислот происходит во время реакции, при которой между остатками аминокислот устанавливается прочная ковалентная связь, называемая пептидной. В результате этой реакции образуется соединение, состоящее из двух аминокислот, – дипептид (рис. 1).
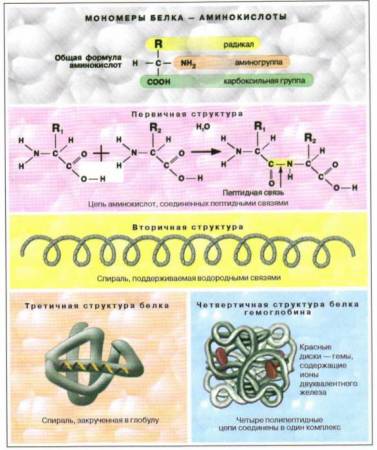 Рис. 1. Схема строения белковой молекулы
Рис. 1. Схема строения белковой молекулы
Если к дипептиду присоединяется еще одна аминокислота, то образуется трипептид и т. д. Все белковые молекулы представляют собой полилептиды, состоящие из большого числа аминокислот.
Структура белковых молекул. Для того чтобы белковая молекула нормально функционировала, она должна иметь совершенно определенную конфигурацию – структуру. Биологическая активность белков обусловлена необыкновенно гибкой и в то же время строго упорядоченной структурой.
Для белковых молекул характерны разные уровни организации (структуры): первичная, вторичная, третичная и четвертичная (см. рис. 1).
Первичная структура представляет собой цепь аминокислот, последовательно соединенных прочными ковалентными пептидными связями.
Более высокий уровень организации белковой молекулы представляет собой вторичная структура. Это – спираль, поддерживаемая многочисленными водородными связями, менее прочными, чем пептидные связи.
Большинство белков имеет еще и третичную структуру, поскольку спираль белковой молекулы свертывается в клубок – глобулу.
Несколько молекул белков могут соединяться между собой, образуя четвертичную структуру. Такую структуру имеют, например, молекулы гемоглобина.
Наиболее устойчива первичная структура белка, остальные легко разрушаются при различных воздействиях среды (температура, соли тяжелых металлов, кислотность и др,).
Свойства белков. Белки могут подвергаться денатурации и ренатурации.
Денатурация заключается в нарушении природной структуры белковой молекулы в результате разрыва химических связей. Природная структура белка – это такая конфигурация молекулы, при которой белок выполняет присущие ему функции. Для белка кератина (он входит в состав кожи, волос, когтей, клюва, перьев и рогов позвоночных животных) природной является вторичная структура, для ферментов и антител – третичная, а для гемоглобина и хлорофилла – четвертичная. При денатурации изменяется не только структура белка, но и его свойства.
Нарушение природной структуры белковой молекулы происходит под влиянием различных факторов среды; высоких температур, ультрафиолетового и рентгеновского излучения, сильных кислот и щелочей, органических растворителей, концентрированных растворов солей, тяжелых металлов и др.
Денатурация может иметь обратимый и необратимый характер. Разрыв связей в первичной структуре приводит к необратимой денатурации (например, к свертыванию яичного белка при варке яиц). Разрыв связей, образующих третичную и даже вторичную структуру, – обратимая денатурация.
Иногда денатурированный белок в подходящих условиях вновь спонтанно приобретает природную структуру, т. е. происходит процесс, противоположный денатурации, – ренатурация. Ренатурация возможна лишь в том случае, если не была нарушена первичная структура белка. Это говорит о том, что форма, а значит, и функция белка полностью зависят от первичной структуры.
Функции белков. В клетке и в организме белки выполняют разнообразные функции.
Структурная функция проявляется в том, что белки входят в состав внутриклеточных структур (например, плазматической мембраны), тканей и органов. Так, белок коллаген служит компонентом соединительной ткани, костей, сухожилий, хрящей; уже упомянутый кератин входит в состав производных эпидермиса: волос, ногтей, рогов, перьев.
Ферментативная функция связана с тем, что все химические реакции в клетке протекают при участии биологически активных веществ – ферментов, которые являются белками. Ферменты – биологические катализаторы, т. е. они обеспечивают высокую скорость протекания всех биохимических реакций, идущих в клетках. Каждый фермент обеспечивает одну или несколько реакций одного типа (известно более 2 тыс. ферментов).
Гормональная функция заключается в том, что некоторые гормоны являются по своей природе белками. Функция гормонов – регуляция обмена веществ в организме. Так, например, белки – гормоны инсулин и глюкагон регулируют обмен глюкозы.
Транспортная функция связана с переносом белками некоторых веществ. Например, гемоглобин переносит кислород в крови позвоночных животных; гемоцианин переносит кислород в гемолимфе некоторых беспозвоночных; белок сывороточный (альбумин) обеспечивает транспорт жирных кислот и липидов.
Защитная функция определяется тем, что глобулярные белки – антитела образуют комплексы с антителами (чужеродными белками) бактерий и вирусов, обеспечивая тем самым иммунные реакции организма. Кроме того, белки фибриноген, фибрин, протромбин и тромбин участвуют в процессах свертывания крови.
Сократительная функция заключается в том, что белки (актин и миозин) обеспечивают мышечное сокращение.
Некоторые белки, встроенные в плазматическую мембрану, способны воспринимать сигналы, идущие из внешней для клетки среды. В этом проявляется их сигнальная функция.
Запасающая функция белков связана с тем, что некоторые белки способны запасать или удерживать определенные вещества. Примером может служить железоудерживающий белок – ферритин.
При расщеплении 1 г белка выделяется 17,1 кДж (4,2 ккал) энергии, поэтому белкам присуща и энергетическая функция. Однако белки в качестве источника энергии используются клеткой только в том случае, когда истощены другие энергетические источники, а именно углеводы и жиры.
Вопросы и задания
- Объясните, почему в различных диетах часто рекомендуется ограничение жиров и углеводов, но не допускается исключение белков.
- Как вы думаете, почему чрезмерное потребление белковой пищи способствует отложению подкожного жира?
- Почему первичная структура белка устойчивее, чем вторичная и третичная?
- Вспомните, какое значение имеют ферменты слюны, желудочного сока и сока поджелудочной железы человека.
- С проявлением какой функции белков связано мерцание ресничек и биение жгутиков у одноклеточных животных?