СОДЕРЖАНИЕ
Световая микроскопия в цитологии
Все исследования структуры клеток проводятся с использованием увеличительных приборов. Основным прибором в биологии служит микроскоп. Он представляет собой оптическую систему, главной характеристикой которой является разрешающая способность, выражающая минимальное расстояние между двумя точками, видимыми раздельно. Разрешение микроскопа зависит от длины волны – чем она меньше, тем меньшего размера объект можно рассмотреть. Разрешающая способность самого современного светового микроскопа соответствует примерно половине длины световой волны. Обычно в световых микроскопах используются источники освещения в видимой области спектра (400–700 нм), в этом случае разрешающая способность может быть не выше 200–350 нм (0,2 – 0,35 мкм). Если использовать ультрафиолетовый свет (260–280 нм), то можно повысить разрешение до 130–140 нм (0,13 – 0,14 мкм). Иногда в световом микроскопе можно увидеть частицы еще меньшей величины за счет их светопреломляющих свойств. Для этого используют боковое освещение препарата, методы фазово-контрастной, интерференционной, поляризационной микроскопии.
Важно отметить, что световой микроскоп позволяет видеть живые клетки. В качестве объектов можно использовать свободноживущие клетки простейших и других одноклеточных организмов, клетки крови или же разобщенные тканевые клетки многоклеточных организмов как животного, так и растительного происхождения.
При изучении живых клеток их окрашивают с помощью так называемых витальных красителей. Широко используются также флуоресцирующие красители и метод флуоресцентной микроскопии. Суть его заключается в том, что некоторые вещества способны светиться (флуоресцировать, люминесцировать) при поглощении ими световой энергии. Например, хлорофилл при освещении ультрафиолетовыми лучами светится красным цветом, витамины A и B2 – желто-зеленым, собственной флуоресценцией обладают некоторые бактериальные пигменты, гормоны.
Метод флуоресцентной микроскопии состоит в следующем: к клеткам добавляют флуоресцирующие красители – флуорохромы, которые избирательно связываются с нуклеиновыми кислотами, липидами, слизью, кератином и др. Часто флуорохромы присоединяют к различным антителам. Например, если ввести меченые антитела к белку, образующему микротрубочки, то с помощью флуоресцентного микроскопа можно с успехом наблюдать микротрубочки в живых клетках.
Электронная микроскопия
Разрешение микроскопа можно увеличить, используя поток электронов вместо светового потока. Именно этот принцип был реализован в электронном микроскопе, при этом получено разрешение в 1 ангстрем (0,1 нм). Такое разрешение было достигнуто для кристаллических материалов. Однако для большинства биологических материалов разрешение 1–2 нм обычно считается пределом из-за низкой контрастности объекта. Поэтому для увеличения контраста биологические объекты обрабатываются солями тяжелых металлов (урана, свинца и др.). В таком случае электронная микроскопия дает в десятки и даже сотни раз большее увеличивающее разрешение по сравнению со световой микроскопией и позволяет подробно изучать ультраструктуру клетки.
В просвечивающих, или трансмиссионных, электронных микроскопах (сокращенно ПЭМ или ТЭМ) изучение объектов проводится на сверхтонких срезах, через которые пучок электронов проходит насквозь. Существуют также электронные микроскопы, получающие изображение объекта в отраженном пучке электронов, их называют сканирующими электронными микроскопами (сокращенно СЭМ). Метод сканирующей электронной микроскопии позволяет изучать трехмерную, объемную картину поверхности клетки. При этом методе фиксированный и обезвоженный объект покрывается тонким слоем металла (золота или платины), от зеркальной поверхности которого отражаются электроны. Разрешающая способность сканирующих электронных микроскопов несколько ниже, чему просвечивающих, тем не менее достигает примерно 3–5 нм.
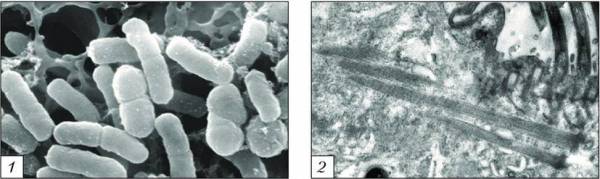 Микрофотография бактерий, выполненная с помощью сканирующего электронного микроскопа (1); микрофотография ресничного аппарата инфузории, выполненная с помощью трансмиссионного электронного микроскопа (2)
Микрофотография бактерий, выполненная с помощью сканирующего электронного микроскопа (1); микрофотография ресничного аппарата инфузории, выполненная с помощью трансмиссионного электронного микроскопа (2)
Цитохимические и гистохимические исследования
Для изучения содержимого клетки, особенностей ее молекулярного состава обычно применяются цитохимические и гистохимические методы исследования. Давно известно, что некоторые химические реакции непосредственно могут выявлять содержание определенных веществ или их отсутствие в клетке. Например, с успехом применяется реакция Фельтена, приводящая к окрашиванию молекул ДНК в пурпурный цвет. Эта реакция позволяет не только определить с большой точностью локализацию ДНК, но и измерить ее количество. Существуют специальные реакции на отдельные аминокислоты, ферменты и др.
Для выяснения локализации и перемещения веществ в клетке широко используют метод радиоавтографии. В этом случае в питательную среду клеток вводится какое-либо вещество, например аминокислота, нуклеотид, жирная кислота или другое вещество, один из атомов которого (углерод, водород и др.) замешен радиоактивным изотопом. Клетка поглощает меченые вещества и включает их в собственные биополимеры, а затем их локализация, перемещение и участие в метаболических процессах регистрируется по радиоактивным меткам. Метод радиоавтографии позволяет изучать даже расположение определенных генов в хромосомах.
Метод фракционирования клеточных структур
Этот метод позволяет выделить из клеток в чистом виде и большом количестве ядра, различные органоиды и другие компоненты клетки. В его основе лежит различная скорость осаждения (седиментация) частиц разного размера и с разным удельным весом, находящихся в жидкости в виде взвеси. Для того чтобы все клеточные структуры оказались в одной общей взвеси, клетки предварительно разрушают – гомогенизируют. Затем полученную гомогенную смесь помещают в специальную пробирку и центрифугируют, чтобы ускорить осаждение частиц. Более крупные и тяжелые частицы первыми оседают на дно, затем оседают более мелкие и легкие. В результате содержимое пробирки разделяется (фракционируется) на несколько разных слоев, каждый из которых содержит одинаковые по плотности органоиды или другие клеточные структуры. Обычно при первом фракционировании на дне пробирки оказывается ядра и неразрушенные клетки, над ними – смесь органоидов, еще выше – наиболее мелкие фрагменты клеточного содержимого.
Для описания размера органоидов и других компонентов клетки обычно используют так называемый коэффициент седиментации, выражаемый в единицах Сведберга – S. Например, коэффициент седиментации рибосомы эукариотической клетки составляет 80S, рибосомы бактериальной клетки – 70S. Название этому показателю было дано в честь шведского ученого Теодора Сведберга, лауреата Нобелевской премии, который в 20-х годах XX века впервые предложил использовать для седиментации белков ультрацентрифугу. Коэффициент седиментации рассчитывают с учетом скорости вращения центрифуги и скорости оседания частиц в разных разбавителях.
Метод клеточных культур
Для изучения клеток органов и тканей животных и растений в последние годы используют метод клеточных культур. Он заключается в том, что в камеру, наполненную питательной средой, помещают небольшой кусочек живой ткани или несколько ее отдельных клеток (у растительных клеток предварительно удаляют клеточную стенку). Через некоторое время клетки начинают размножаться, образуя сначала колонии, а затем сплошной клеточный пласт. Используя клеточные культуры, удается проводить длительные исследования на однородном клеточном материале. Существуют специальные клеточные культуры, десятилетиями выращиваемые вне организма. Сейчас метод культивирования клеток вне организма широко используется не только для цитологических, но и для генетических, вирусологических и биохимических исследований.
При изучении живых клеток в последние годы часто используют методы микрохирургии – оперативного воздействия на клетки. С помощью прибора микроманипулятора клетки разрезают, извлекают из них части, вводят определенные вещества (микроинъекция) и т. д. Микроманипулятор совмещается с обычным микроскопом, в который наблюдают за ходом операции. Так, с помощью микрохирургии удалось пересадить ядра от одного штамма амебы другому и доказать, что именно клеточное ядро определяет физиологические особенности всей клетки.
Несмотря на важность и относительную простоту прижизненных наблюдений, большая часть сведений о структуре и свойствах клеток получена на фиксированном материале. Фиксаторы (альдегиды, спирты и другие вещества и их смеси) позволяют предотвратить распад клеточных компонентов в мертвых клетках и тканях. После фиксации объекты можно подвергать дополнительной обработке, например окрашиванию. Можно изготавливать очень тонкие срезы тканей и клеток (толщиной 5–10 мкм) на специальном приборе – микротоме. Для изготовления постоянных препаратов окрашенные срезы обезвоживаются и помещаются в специальную прозрачную смолу («канадский бальзам») под покровным стеклом; эти препараты можно хранить длительное время.
Благодаря применению разнообразных химических, физических и биологических методов исследования, использованию технических достижений XX век был ознаменован значительными успехами в изучении свойств клетки.