Химический состав белков. Из органических веществ клетки на первом месте по количеству и значению стоят белки. В состав всех белков входят атомы водорода, кислорода, азота. Во многие белки входят, кроме того, атомы серы. Есть белки, в состав которых входят также атомы металлов – железа, цинка, меди.
В отличие от других органических соединений белки обладают рядом особенностей. Прежде всего белкам присуща громадная молекулярная масса. Сравните: молекулярная масса спирта – 46, уксусной кислоты – 60, бензола – 78. а альбумина (одного из белков яйца) – 36 000, гемоглобина (белка из красных кровяных клеток) – 152 000, миозина (одного из белков мышц) 500000. Ясно, что по сравнению с молекулами спирта, уксусной кислоты, бензола и другими молекулы белков великаны. В их построении участвуют тысячи атомов. Для того чтобы подчеркнуть гигантский размер таких молекул, их называют макромолекулами (греч. «макрос» – большой, гигантский).
Строение белков. Среди органических соединений белки самые сложные. Они относятся к соединениям, называемым полимерами. Молекула полимера представляет длинную цепь, в которой много раз повторяется одна и та же сравнительно простая структура, называемая мономером. Если обозначить мономер буквой А, то структуру полимера можно изобразить так: А–А–А–А–А.
Кроме белков в природе существует много других полимеров, например целлюлоза, крахмал, каучук. В химической промышленности создано много искусственных полимеров – полиэтилен, лавсан, капрон и др.
Большинство природных и искусственных полимеров построены из одинаковых мономеров. Белки же состоят из сходных, но не вполне одинаковых мономеров. Мономерами белков являются аминокислоты. Как видно на рисунке 70, молекула аминокислоты как бы состоит из двух частей. Одна часть (черными буквами) у всех аминокислот одинаковая. Это группировка 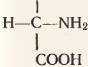 . Она состоит из аминогруппы (–NH2) и находящейся рядом карбоксильной группы (–СООН). Другая часть молекулы у всех аминокислот разная (она напечатана красными буквами). Эта часть называется радикалом.
. Она состоит из аминогруппы (–NH2) и находящейся рядом карбоксильной группы (–СООН). Другая часть молекулы у всех аминокислот разная (она напечатана красными буквами). Эта часть называется радикалом.
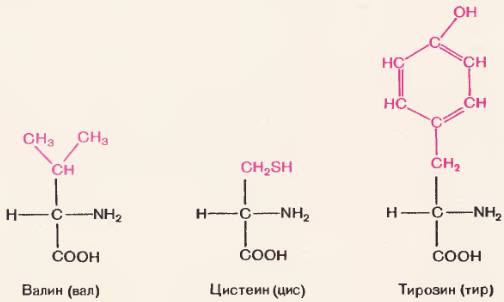 Рис. 70. Строение аминокислот
Рис. 70. Строение аминокислот
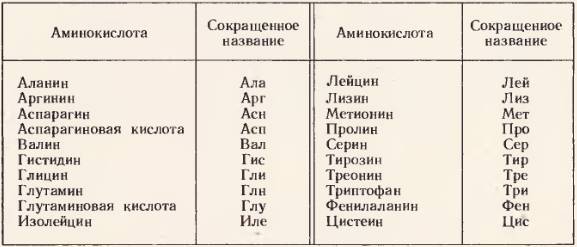
Известно много разных аминокислот. Но в качестве мономеров любых природных белков – животных, растительных„микробных, вирусных – известно только 20 аминокислот. Они получили название «волшебных». Их список представлен в таблице.
Тот факт, что белки всех организмов построены из одних и тех же аминокислот – еще одно доказательство единства живого мира на Земле.
Двадцать аминокислот, входящих в состав природных белков («волшебные» аминокислоты)
Соединение аминокислот при образовании белковой молекулы осуществляется через общую для всех аминокислот группировку. Чтобы лучше это понять, рассмотрите рисунок 71: из карбоксильной группы одной аминокислоты и аминогруппы соседней аминокислоты отщепляется молекула воды и за счет освободившихся валентностей остатки аминокислот соединяются. Между аминокислотами возникает прочная ковалентная связь 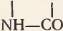 называемая пептидной связью. Образовавшееся соединение аминокислот называется пептидом. Пептид из двух аминокислот называется дипептидом, из трех аминокислот – трипептидом, из многих аминокислот – полипептидом. Все белки представляют собой полипептиды, т. е. цепи из многих десятков и даже сотен аминокислотных звеньев.
называемая пептидной связью. Образовавшееся соединение аминокислот называется пептидом. Пептид из двух аминокислот называется дипептидом, из трех аминокислот – трипептидом, из многих аминокислот – полипептидом. Все белки представляют собой полипептиды, т. е. цепи из многих десятков и даже сотен аминокислотных звеньев.
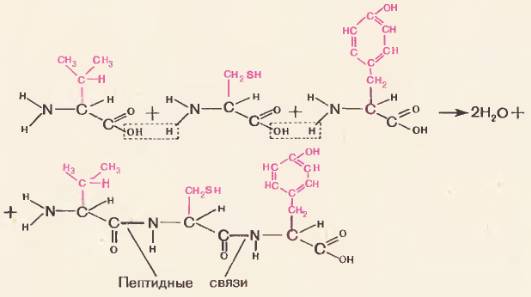 Рис. 71. Соединение аминокислот в пептидную цепь
Рис. 71. Соединение аминокислот в пептидную цепь
Каждый живой организм содержит большое число различных белков. При этом каждому виду присущи особенные, свойственные только данному виду белки. Даже белки, выполняющие у разных видов животных одну и ту же функцию, отличаются друг от друга. Например, у всех позвоночных животных– рыб, амфибий, птиц, млекопитающих – красные клетки крови содержат белок гемоглобин, выполняющий у всех животных одну и ту же функцию транспорт кислорода. Но гемоглобин у каждого вида животных свой, особенный, по структуре и свойствам отличающийся от гемоглобинов других животных.
Для того чтобы объяснить возможность существования такого громадного разнообразия белков, нужно учесть, что белки различаются по составу аминокислот, по числу аминокислотных звеньев, по порядку следования в цепи. Число структурных вариантов достигает при этом астрономических цифр.
В докладе индийского ученого Синга на биохимическом конгрессе в Москве был приведен следующий любопытный расчет. Белок с молекулярной массой 34 000 содержит около 300 аминокислотных звеньев (молекулярная масса одного аминокислотного звена в среднем равна 110). Пусть в состав этого белка входят не все 20 аминокислот, а только 12. При таких условиях число возможных изомеров для этого белка оказывается равным 10 300 . Для того чтобы ощутить громадность этой цифры, представим себе 10 300 однокопеечных монет. Такая груда монет весит 10 300 г (одна однокопеечная монета весит 1 г). Масса же земного шара 1027 г!
Если учесть, что размер одного аминокислотного звена равен 0,35 – 0,37 им, то очевидно, что макромолекула белка, которая состоит из сотен аминокислотных остатков, должна была бы иметь в длину несколько десятков нанометров. В действительности же размеры молекул белков гораздо меньше. Некоторые из них имеют вид шариков с диаметром всего 5 – 7 нм. Полипептидная цепь белка как-то скручена, как-то уложена. Каждому белку присущ строго определенный характер укладки. Для полной характеристики строения белковой молекулы требуется знание его первичной, вторичной и третичной структур.
Последовательность аминокислотных остатков в молекуле белка определяет его первичную структуру. Это как бы формула белка. На рисунке 72 представлена первичная структура белка рибонуклеазы. В состав этого белка входят 124 аминокислотных звена. Чаще всего полипептидная цепь полностью или частично закручивается в спираль. Это вторичная структура белка. Аминокислотные радикалы остаются при этом снаружи спирали. Витки спирали располагаются тесно. Между NH-группами, находящимися на одном витке, и CO-группами, находящимися на соседнем витке, образуются водородные связи [72]. Водородные связи значительно слабее ковалентных, но, повторенные многократно, они дают прочное сцепление. Полипептидная спираль, «прошитая» многочисленными водородными связями, представляет достаточно прочную структуру.
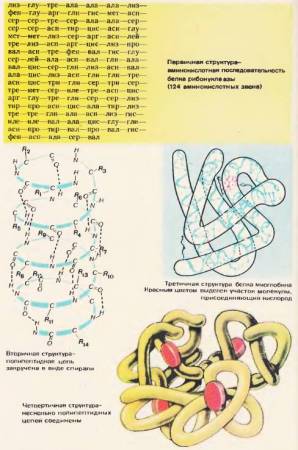 Рис. 72. Уровни структурной организации белка
Рис. 72. Уровни структурной организации белка
Полипептидная спираль подвергается дальнейшей укладке. Она сворачивается причудливо, но для каждого белка вполне определенно и постоянно. В результате возникает конфигурация, называемая третичной структурой [72]. Третичную структуру поддерживают гидрофобные связи, которые возникают между радикалами гидрофобных аминокислот. Эти связи слабее водородных. В водной среде в клетке гидрофобные радикалы отталкиваются от воды и слипаются друг с другом. Таким образом, водная среда как бы принуждает белковую молекулу принять определенную упорядоченную структуру, и она становится биологически активной.
Третичная структура не является высшей формой структурной организации белка. В живой клетке обнаружено много других, еще более сложных ее форм, например четвертичные [72].
1. Каковы особенности строения белка как полимера? 2. Чем отличаются белки как полимеры от таких природных полимеров, как крахмал, целлюлоза, каучук? От искусственных полимеров (полиэтилена, лавсана и др.)? 3. Что представляет собой первичная структура белка? 4. Что представляет собой вторичная, третичная структуры белка?